Molecular and physiological characterization of a crustacean cardioactive signaling system in a lophotrochozoan – the Pacific oyster (Crassostrea gigas): a role in reproduction and salinity acclimation
Molecular and physiological characterization of a crustacean cardioactive signaling system in a lophotrochozoan – the Pacific oyster (Crassostrea gigas): a role in reproduction and salinity acclimation
Emilie Réalis-Doyelle, Julie Schwartz, Marie-Pierre Dubos and Pascal Favrel (2021). Molecular and physiological characterization of a crustacean cardioactive signaling system in a lophotrochozoan – the Pacific oyster (Crassostrea gigas): a role in reproduction and salinity acclimation. Journal of Experimental Biology, 224 (10). doi.org/10.1242/jeb.241588
Le peptide cardioactif des crustacés (CCAP) est un important neuropeptide impliqué dans la régulation de divers processus physiologiques chez les arthropodes. Bien que cette famille de peptides ait une origine ancestrale, sa fonction reste mal comprise chez les protostomes, à l’exception des arthropodes. Nous avons caractérisé fonctionnellement trois récepteurs couplés aux protéines G (GPCRs) phylogénétiquement liés aux récepteurs de CCAP d’ecdysozoaires (CCAPRs) et aux récepteurs du neuropeptide S de chordés (NPSRs) chez l’huître Crassostrea gigas. Cragi-CCAPR1 et Cragi-CCAPR2 ont été spécifiquement activés par les peptides Cragi-CCAP1 et Cragi-CCAP2, respectivement, tous deux dérivés du même précurseur du CCAP. En revanche, le Cragi-CCAPR3 n’a été que partiellement activé par la CCAP1 et la CCAP2 à des concentrations élevées. Les gènes Cragi-CCAPR1 et Cragi-CCAPR2 sont exprimés dans divers tissus adultes. Ils sont tous les deux plus exprimés dans les branchies, tandis que Cragi-CCAPR3 est principalement exprimé dans les ganglions viscéraux (GV). Les transcrits codant le précurseur de Cragi-CCAP sont exprimés de manière plus importante dans les GV, les palpes labiaux et les branchies. Les transcrits codant les récepteurs et les ligands sont plus abondamment exprimés dans les gonades aux premiers stades de la gamétogenèse, tandis que le précurseur Cragi-CCAP est principalement exprimé dans les GV aux derniers stades de la gamétogenèse. Ceci suggère un rôle de la signalisation CCAP dans la régulation des processus de reproduction. Un rôle dans la régulation hydrique et ionique est également suggéré compte tenu de l’expression différentielle des composants de la signalisation CCAP chez des huîtres exposées à l’eau saumâtre.
Contact : Pascal Favrel, pascal.favrel@unicaen.fr
Légendes figures :
Fig. 1. Alignement de séquences des membres de la famille des récepteurs de CCAP. et de neuropeptide S. Alignement CLUSTAL OMEGA.* indique les récepteurs caractérisés fonctionnellement. Les flèches noires pleines indiquent la position des introns conservés et les flèches noires vides celle des introns non conservés. TM : 7 domaines transmembranaires. © Journal of Experimental Biology
Fig. 2. Position phylogénétique des récepteurs d’huitre (Cragi-CCAPRs) par rapport aux autres membres de la famille des CCAPRs. Maximum de vraisemblance (Seaview). Anoca : Anolis carolinensis, Anoga : Anopheles gambiae, Apime : Apis mellifera, Aplca Aplysia californica, Cragi : Crassostrea gigas, Capte : Capitela teleta, Dapma : Daphnia magna, Drome: Drosophila melanogaster, Galga : Gallus gallus, Helro : Helobdella robusta, Homsa : Homo sapiens, Lotgi : Lottia gigantea, Musmu : Mus musculus, Nillu : Nilaparvata lugens, Octvu : Octopus vulgaris, Patye : Patinopecten yessoensis, Pecma : Pecten maximus, Phopy : Photinus pyralis, Sepof : Sepia officinalis, Strpu: Strongylocentrotus purpuratus, Trica : Tribolium castaneum. * indique des récepteurs caractérisés fonctionnellement. © Journal of Experimental Biology
Fig. 3. Alignement des peptides de la famille des CCAP. Aplca : Aplysia californica, Cragi : Crassostrea gigas, Capte : Capitela teleta, Galga : Gallus gallus, Homsa : Homo sapiens, Lotgi : Lottia gigantea, Sepof : Sepia officinalis, Strpu: Strongylocentrotus purpuratus, Trica : Tribolium castaneum : NPS : Neuropeptide S, OT : Ocytocin. © Journal of Experimental Biology
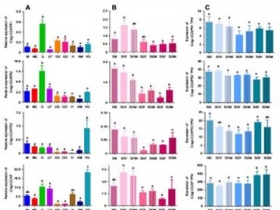
Fig. 5. Expression du précurseur et des récepteurs de CCAP chez C. gigas. A. Expression dans les tissus adultes : M : Manteau ; ME : Bord du manteau ; G : branchies ; LP : palpes labiaux ; DG : glande digestive ; Go : Gonad (mix de toutes les étapes) ; H : Cœur ; AM : muscle adducteur ; VG : Ganglions viscéraux, B. Expression dans les gonades au cours du cycle de gamétogenèse C. Expression dans les ganglions viscéraux au cours du cycle de gamétogenèse. Stade 0 : stade de repos sexuel ; stade 1 : étape de multiplication goniale ; stade 2 : stade de développement et de maturation des tubules et stade 3 : stade de maturité sexuelle. F : Femelle, M : Mâle. Chaque valeur est la moyenne + SEM de 5 pools de 6 animaux. Les résultats ont été testés statistiquement avec une ANOVA unidirectionnelle p<0,05. Les barres verticales représentent l'erreur standard de la moyenne (SEM). © Journal of Experimental Biology
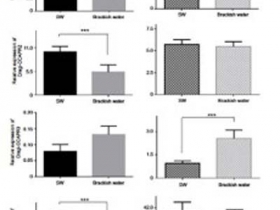
Fig. 6. Rôle de la signalisation CCAP dans l’acclimatation à un stress hyposalin. Distribution des ARNm codant pour Cragi-CCAPR1, Cragi-CCAPR2, Cragi-CCAPR3 et le précurseur de Cragi-CCAP dans les branchies (A) et la ganglions viscéraux (B) des huîtres transférées dans l'eau saumâtre. SW: eau de mer, BW: eau saumâtre: chaque valeur est la moyenne +/- SEM de 5 pools de 5 animaux. Les moyennes significativement différentes (test t de Student) entre les animaux témoins et conditionnés sont indiquées par *** (p <0,001). © Journal of Experimental Biology