Molecular and physiological characterization of a crustacean cardioactive signaling system in a lophotrochozoan – the Pacific oyster (Crassostrea gigas): a role in reproduction and salinity acclimation
Molecular and physiological characterization of a crustacean cardioactive signaling system in a lophotrochozoan – the Pacific oyster (Crassostrea gigas): a role in reproduction and salinity acclimation
Emilie Réalis-Doyelle, Julie Schwartz, Marie-Pierre Dubos and Pascal Favrel (2021). Molecular and physiological characterization of a crustacean cardioactive signaling system in a lophotrochozoan – the Pacific oyster (Crassostrea gigas): a role in reproduction and salinity acclimation. Journal of Experimental Biology, 224 (10). doi.org/10.1242/jeb.241588
The crustacean cardioactive peptide (CCAP) is an important neuropeptide involved in the regulation of a variety of physiological processes in arthropods. Although this family of peptides has an ancestral origin, its function remains poorly understood among protostome species – apart from arthropods. We functionally characterized three G protein-coupled receptors (GPCRs) in the oyster Crassostrea gigas, phylogenetically related to ecdysozoan CCAP receptors (CCAPRs) and to chordate neuropeptide S receptors (NPSRs). Cragi-CCAPR1 and Cragi-CCAPR2 were specifically activated by the Cragi-CCAP1 and Cragi-CCAP2 peptides, respectively, both derived from the same CCAP precursor. In contrast, Cragi-CCAPR3 was only partially activated by CCAP1 and CCAP2 at high concentrations. The Cragi-CCAPR1 and Cragi-CCAPR2 genes were expressed in various adult tissues. They are both most expressed in the gills, while Cragi-CCAPR3 is mainly expressed in the visceral ganglia (VG). Cragi-CCAP precursor transcripts are higher in the VG, the labial palps and the gills. Receptor and ligand-encoding transcripts are more abundantly expressed in the gonads in the first stages of gametogenesis, while the Cragi-CCAP precursor is upregulated in the VG in the last stages of gametogenesis. This suggests a role of the CCAP signaling system in the regulation of reproductive processes. A role in water and ionic regulation is also supported considering the differential expression of the CCAP signaling components in oysters exposed to brackish water.
Contact: Pascal Favrel, pascal.favrel@unicaen.fr
Picture title:
Fig. 1. Alignement de séquences des membres de la famille des récepteurs de CCAP. et de neuropeptide S. Alignement CLUSTAL OMEGA.* indique les récepteurs caractérisés fonctionnellement. Les flèches noires pleines indiquent la position des introns conservés et les flèches noires vides celle des introns non conservés. TM : 7 domaines transmembranaires. © Journal of Experimental Biology
Fig. 2. Position phylogénétique des récepteurs d’huitre (Cragi-CCAPRs) par rapport aux autres membres de la famille des CCAPRs. Maximum de vraisemblance (Seaview). Anoca : Anolis carolinensis, Anoga : Anopheles gambiae, Apime : Apis mellifera, Aplca Aplysia californica, Cragi : Crassostrea gigas, Capte : Capitela teleta, Dapma : Daphnia magna, Drome: Drosophila melanogaster, Galga : Gallus gallus, Helro : Helobdella robusta, Homsa : Homo sapiens, Lotgi : Lottia gigantea, Musmu : Mus musculus, Nillu : Nilaparvata lugens, Octvu : Octopus vulgaris, Patye : Patinopecten yessoensis, Pecma : Pecten maximus, Phopy : Photinus pyralis, Sepof : Sepia officinalis, Strpu: Strongylocentrotus purpuratus, Trica : Tribolium castaneum. * indique des récepteurs caractérisés fonctionnellement. © Journal of Experimental Biology
Fig. 3. Alignement des peptides de la famille des CCAP. Aplca : Aplysia californica, Cragi : Crassostrea gigas, Capte : Capitela teleta, Galga : Gallus gallus, Homsa : Homo sapiens, Lotgi : Lottia gigantea, Sepof : Sepia officinalis, Strpu: Strongylocentrotus purpuratus, Trica : Tribolium castaneum : NPS : Neuropeptide S, OT : Ocytocin. © Journal of Experimental Biology
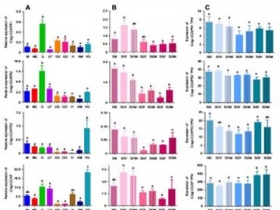
Fig. 5. Expression du précurseur et des récepteurs de CCAP chez C. gigas. A. Expression dans les tissus adultes : M : Manteau ; ME : Bord du manteau ; G : branchies ; LP : palpes labiaux ; DG : glande digestive ; Go : Gonad (mix de toutes les étapes) ; H : Cœur ; AM : muscle adducteur ; VG : Ganglions viscéraux, B. Expression dans les gonades au cours du cycle de gamétogenèse C. Expression dans les ganglions viscéraux au cours du cycle de gamétogenèse. Stade 0 : stade de repos sexuel ; stade 1 : étape de multiplication goniale ; stade 2 : stade de développement et de maturation des tubules et stade 3 : stade de maturité sexuelle. F : Femelle, M : Mâle. Chaque valeur est la moyenne + SEM de 5 pools de 6 animaux. Les résultats ont été testés statistiquement avec une ANOVA unidirectionnelle p<0,05. Les barres verticales représentent l'erreur standard de la moyenne (SEM). © Journal of Experimental Biology
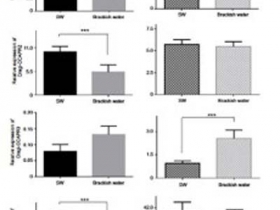
Fig. 6. Rôle de la signalisation CCAP dans l’acclimatation à un stress hyposalin. Distribution des ARNm codant pour Cragi-CCAPR1, Cragi-CCAPR2, Cragi-CCAPR3 et le précurseur de Cragi-CCAP dans les branchies (A) et la ganglions viscéraux (B) des huîtres transférées dans l'eau saumâtre. SW: eau de mer, BW: eau saumâtre: chaque valeur est la moyenne +/- SEM de 5 pools de 5 animaux. Les moyennes significativement différentes (test t de Student) entre les animaux témoins et conditionnés sont indiquées par *** (p <0,001). © Journal of Experimental Biology