Baptiste HOUYVET, doctorant de l'équipe 7, UMR BOREA, a soutenu sa thèse en huis-clos :
"Identification de peptides antibactériens d’origine marine : Amélioration de la qualité et de la survie du naissain d’huître"
Vendredi 13 avril 2018 à l' Université de Caen-Normandie
Devant un jury composé de :
Mme Céline LANDON, CR1 CNRS (Orléans), Rapporteur
Mr Alain DUFOUR, PR, UBS (Lorient), Rapporteur
Mr Vianney PICHEREAU, PR, UBO( Brest), Examinateur
Mr Joël HENRY PR, Normandie Université (Caen), Examinateur
Mme Céline ZATYLNY-GAUDIN MC, Normandie Université (Caen) Directrice de thèse
Résumé :
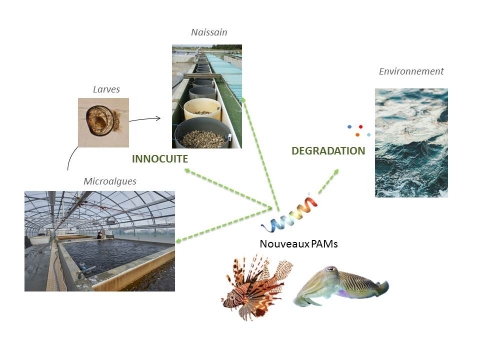
Les premiers stades larvaires chez l’huitre creuse, nommée Magallana gigas, constituent une étape clé du bon déroulement du parcours zootechnique et également pour la pérennisation de la production en l’écloserie. Dans l’objectif de réduire les mortalités observées en écloserie, nous avons recherché de nouveaux peptides antimicrobiens. La recherche de ces PAMs a été réalisée à partir de deux organismes marins, le poisson-lion invasif en mer des caraïbes, Pterois volitans et la seiche commune présente sur les zones ostréicoles, Sepia officinalis. La recherche de PAMs a été réalisé préférentiellement à partir de transcriptomes de novo obtenus chez ces deux animaux. Chez le poisson lion, à partir de BLAST, 7 transcrits codant pour des PAMS ont été identifiés Quatre de ces PAMs partagent de fortes homologies de séquences (>90% d’identité) pour des PAMs riches en cystéines proches de l’hepcidine, la LEAP-2, la NK-lysine et la b-défensine identifiées chez d’autres poissons. Les 3 autres transcrits annotées pteroicidines A, B et C codent pour des peptides apparentés aux piscidines. La présence de la b-défensine et de la pteroicidine a codée par la pteroicidine A a pu être confirmée dans les extrait de peau du poisson lion par spectrométrie de masse. Une étude approfondie a été menée sur deux formes amidée et non amidé de la pteroicidine a ainsi que sur plusieurs peptides de différentes tailles issus des pteroicidines B et C. Les résultats ont permis de mettre en évidence une relation entre la structure, l’amidation et les activités antibactériennes et hémolytiques de ces différentes ptéroicidines. Sur le modèle Sepia officinalis, par les approches classiques couplant la purification et les tests antibactériens ou par des approches utilisant les Blast aucun PAM n’a été mis en évidence. Nous avons donc développé une approche plus originale qui repose sur le « design » de peptides à partir du transcriptome. A partir de 811 petits peptides sans cystéines issus de la base de données APD, nous avons déterminé des critères récurrents concernant la charge, l’hydrophobicité et la composition en acides aminés. Sur la base de ces critères et en s’appuyant sur les outils de prédiction de CAMP, douze peptides ont fait l’objet d’une synthèse. Cinq de ces peptides ont révélé un large spectre d’activités antibactériennes. Les peptides antibactériens issus de la seiche ayant une activité non hémolytiques ont fait l’objet d’un transfert en écloserie. Ce transfert a été optimisé à partir d’une étude préliminaire sur le peptide de novo K4, particulièrement actif sur les vibrios. Cette étude a mis en évidence l’importance de l’innocuité du peptide antibactérien sur les différents maillons de la chaine trophique notamment de l’huitre et sur l’importance du stade de développement ciblé. Par ailleurs, nous nous sommes intéressés au devenir des peptides antibactériens de manière à s’assurer de leur biodégradabilité. L’ensemble de ces travaux a permis non seulement d’identifier de nouveaux PAMs mais également d’apporter les premières données portant sur le potentiel de l’utilisation de ces peptides comme alternative aux antibiotiques.
