Deciphering shell proteome within different Baltic populations of mytilid mussels illustrates important local variability and potential consequences in the context of changing marine conditions
Deciphering shell proteome within different Baltic populations of mytilid mussels illustrates important local variability and potential consequences in the context of changing marine conditions
Deciphering shell proteome within different Baltic populations of mytilid mussels illustrates important local variability and potential consequences in the context of changing marine conditions. J. Aviralagan, B. Marie, G. Chiapetta, J. Vinh, X. Gallet, M. Lebon, S. M'Zoudi, P. Dubois, S. Berland, A. Marie. Science of the Total Environment 745 (2020). doi.org/10.1016/j.scitotenv.2020.140878
Le succès radiatif des mollusques ne se dément pas et peut être soutenu par le développement de la coquille chez beaucoup, en protection de prédation et de stress environnemental. La coquille calcifiée devient pourtant source de vulnérabilité face au changement global des océans, objets de déséquilibre ionique et de saturation décroissante en carbonate de calcium. Le maintien de la coquille chez les organismes marins face à ces conditions, est plus coûteux en énergie jusqu'à engager un pronostique défavorable. En ce sens, les mollusques marins offrent un champ de recherche au suivi des effets du changement global.
Les protéines de matrice de coquille sont le relais in situ du contrôle moléculaire de la biominéralisation. L'analyse par protéomique différentielle des protéines de matrice de coquille chez des populations de moule bleue de mer du Nord, par comparaison à celles de populations vivant en mer Baltique, soumise à des eaux à apport fluvial modifiant salinité et pH; a mis en évidence la modulation de protéines de matrice de la coquille en lien avec son phénotype et sa résistance mécanique.
Chez les individus de mer Baltique, la résistance de la coquille à la fracture est plus faible et on observe une modulation de protéines liées à la biominéralisation ; une augmentation relative des protéines de liaison à la chitine et une diminution de protéines à motifs répétés (SD et GA-rich), correspondant à une altération de protéines de trame et de nucléation minérale. Une altération de la microstructure est également constatée. Il est à noter que certaines protéines de matrice, fonctionnellement liées à l'immunité apparaissent modulées.
Les traits phénotypiques tels que : épaisseur du périostracum, fraction organique et résistance à la fracture corrèlent avec la modulation de protéines fonctionnelles dans la coquille, donnant des pistes sur le jeu du contrôle de la biominéralisation au niveau moléculaire dans le contexte de l'évolution des conditions environnementales.
Légende photo d'illustration : La relation entre les propriétés de la coquille et son protéome chez les moules bleues de la mer Baltique, vivant dans un environnement marin impacté par un fort apport fluvial, par comparaison avec une population vivant en mer du Nord en environnement marin ouvert, est étudiée dans la perspective de l'impact du changement global. La modulation de protéines de la matrice de la coquille est fonction de l'environnement qui porte influence aux propriétés mécaniques et aux traits phénotypiques des coquilles. Certaines protéines de matrice, fonctionnellement liées à l'immunité, apparaissent également modulées.
Légendes photos en galerie d'images (ci-dessous) :
Photo 1 : Scanning electron microscopy images show altered microstructure of Baltic mussel shells. The region of the shell used for acquiring the images is the interface of the nacreous layer, myostracum and prismatic layer of the shells from the North sea and the Baltic sea (Nynäshamn site). In Baltic mussels the nacreous layer is formed by relatively thin aragonite tablets compared to North Sea mussels (arrows). © Sophie Berland
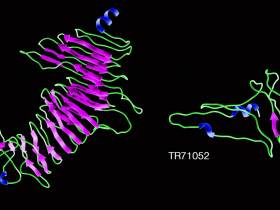
Photo 2 : Predicated structure of scaffolding shell matrix proteins TR78416 and TR71052 predicted using the I-Tasser tool. TR78416 proteins contain motifs that are formed by β-strand-turn-β-strand and are similar to that of spider silk. Primary protein sequences present low complexity domains with the GGXGG repeating motifs. © Sophie Berland
Contact BOREA : Sophie Berland